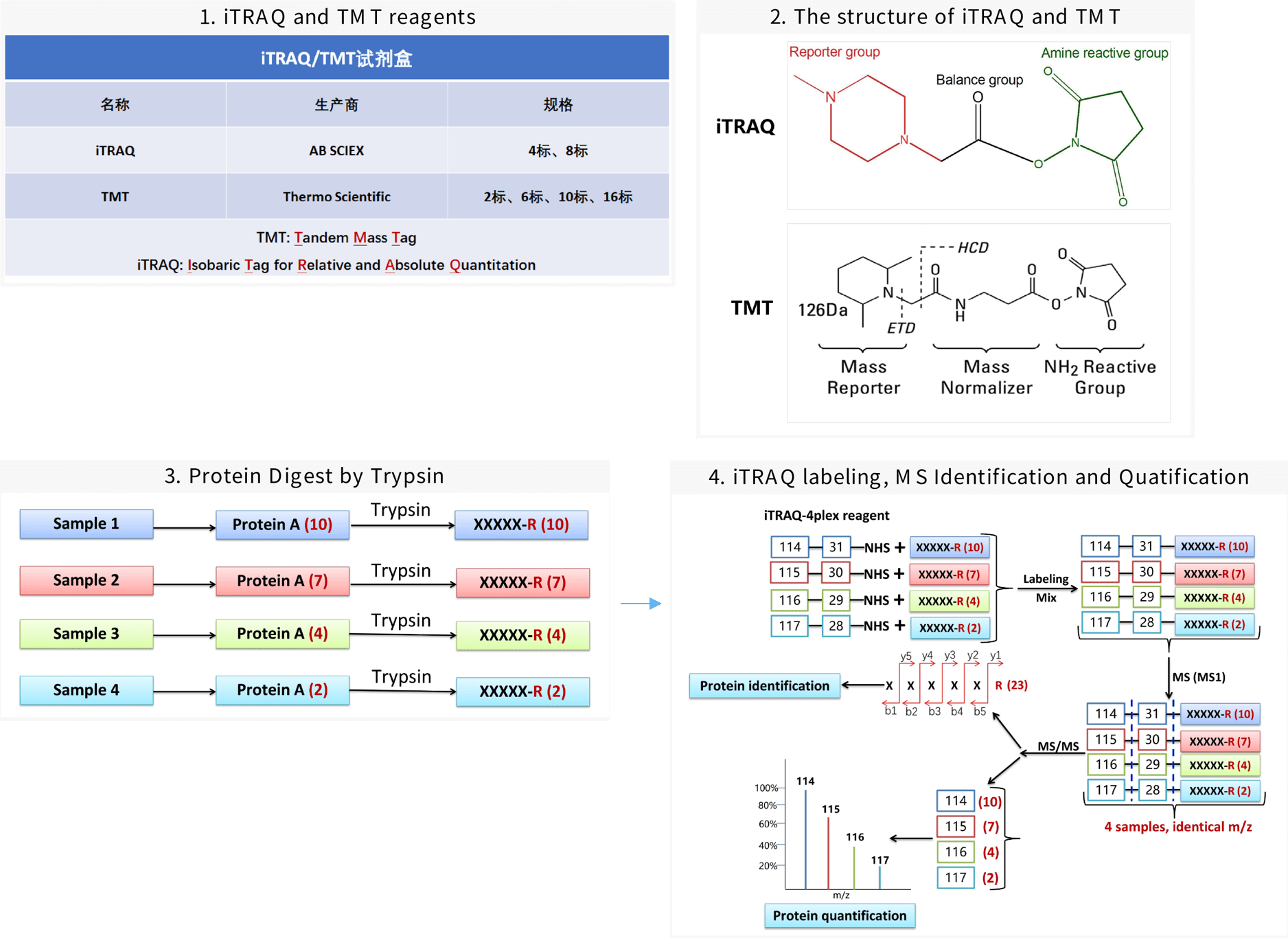
iTRAQ (Isobaric Tag for Relative and Absolute Quantitation) 和 TMT(Tandem Mass Tag) 分别是由AB SCIEX和ThermoFisher Scientific公司分别开发的、对trypsin酶解肽段进行标记的试剂盒。标记的肽段通过LC-MS分析,能同时实现对蛋白质的鉴定和定量。二者的应用原理一样,区别是分子组成和结构有所差异。
与SILAC (Stable Isotope Labeling with Amino acids in Cell culture) 定量原理不同,iTRAQ/TMT技术是通过二级MS(MS/MS,MS2)实现对蛋白质的定量分析。
iTRAQ/TMT几乎能兼容所有来源的蛋白质样品,能同时分析的样品数目范围在2-18组,为实验设计和样品分析提供了更大的可调节性。
iTRAQ/TMT试剂分子组成及MS定量原理:
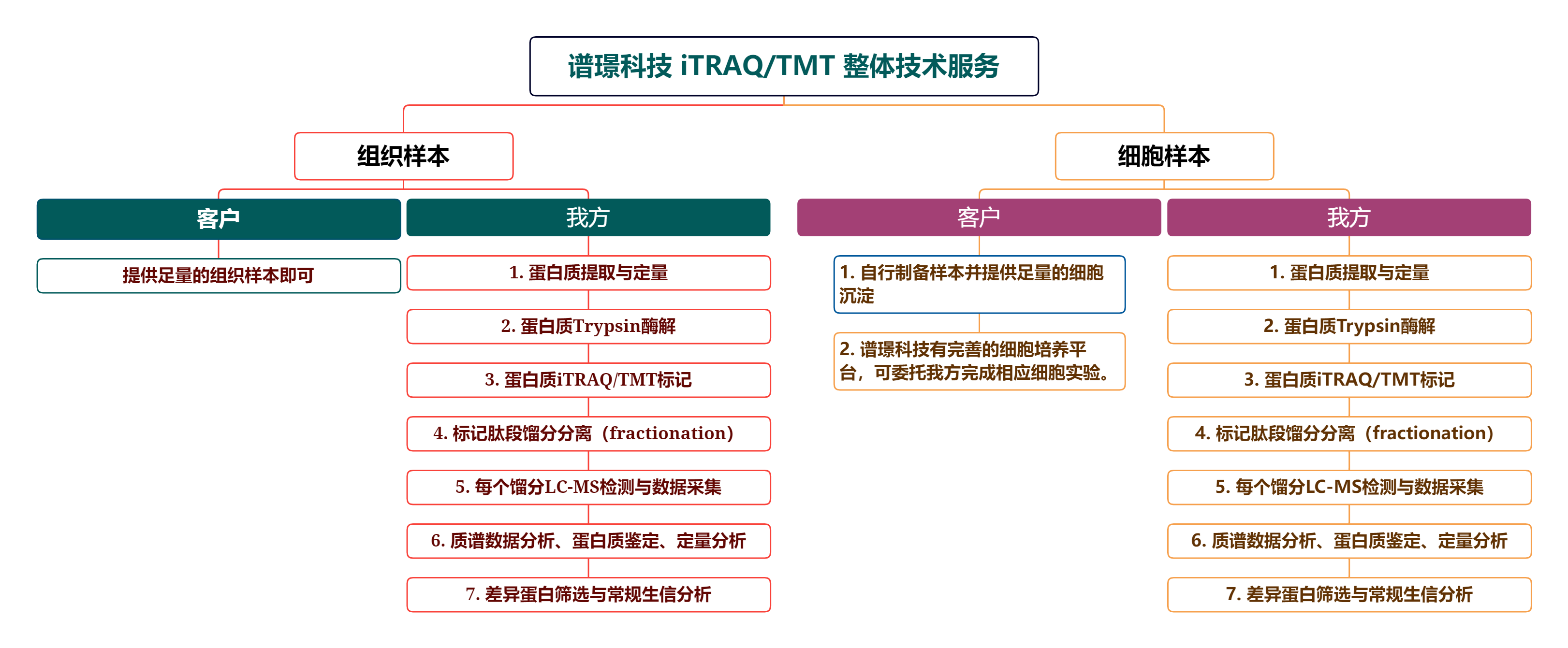
*组织和细胞样本的iTRAQ/TMT技术服务*
对于组织和细胞样品,蛋白质组的动态范围(dynamic range)跨度约为7-8个数量级(7-8 log),比血浆、血清、脑脊液等体液低很多,可用iTRAQ/TMT技术结合馏分分离(fractionation)实现对蛋白质组的深度覆盖鉴定。
对于细胞样本,亦可选择SILAC技术方案,流程简单,系统误差小,定量准确度高。但SILAC技术的通量较低,常规SILAC能同时分析3组(K0R0 vs. K4R6 vs. K8R10),Neucode-SILAC技术尽管能同时分析很多组,但试剂成本和对质谱测试要求均比较高,限制了其大规模的应用。
参考文献:
Analytical Chemistry 2020, 92(10):7162-7170. (TMT)
Current protocols in protein science 2019, 95(1):e74. (SILAC)
Nature protocols 2018, 13(1):293-306. (Neucode-SILAC)
Cell Systems 2017, 4(6):587-599.e584. (Label-free)
*体液(血浆、血清、脑脊液、尿液)样本的iTRAQ/TMT技术服务*
对于体液样本,尤其是血浆/血清,蛋白质组动态范围(dynamic range)跨度为10-12个数量级(10~12 log),并且约20种高丰度蛋白占据了血浆/血清总蛋白的99%,剩余的1万~几万的蛋白质都在1%的低丰度区域。目前,创痛的、基于质谱的技术对血浆/血清蛋白质组解析度不足(覆盖度不足10%),血浆/血清低丰度蛋白的检出率很低。我们“看不到”更多蛋白,尤其是低丰度蛋白,疾病相关分子标志物的筛选都是空谈。
常规的血浆/血清蛋白质组iTRAQ/TMT流程包括:(1)高丰度蛋白去除(Depletion,去除步骤本身会导致样本偏差),(2)肽段iTRAQ/TMT标记(Labeling),(3)标记肽段馏分分离(Fractionation),(4)馏分质谱检测(MS measurement)。 整体的DLFM流程繁琐,并且都要手动操作,系统误差大。
2020年美国Seer公司推出了ProteographTM技术平台,该平台与质谱技术无缝融合,实现了快速、高-深度和可规模化的血浆蛋白质探索,平均每个样本能检测到蛋白质数目>2000种,动态范围(dynamic range)跨越8-9个数量级(8-9 log),能检测到的、浓度低于10ng/ml的血浆蛋白质数目超过1000种,发现了众多的、“新”的与疾病相关的血浆蛋白。
传统DLFM流程与ProteographTM对比如下图所示,血浆蛋白质组深度探索与biomarker筛选/发现的新时代已来,请转换跑道,面向未来!
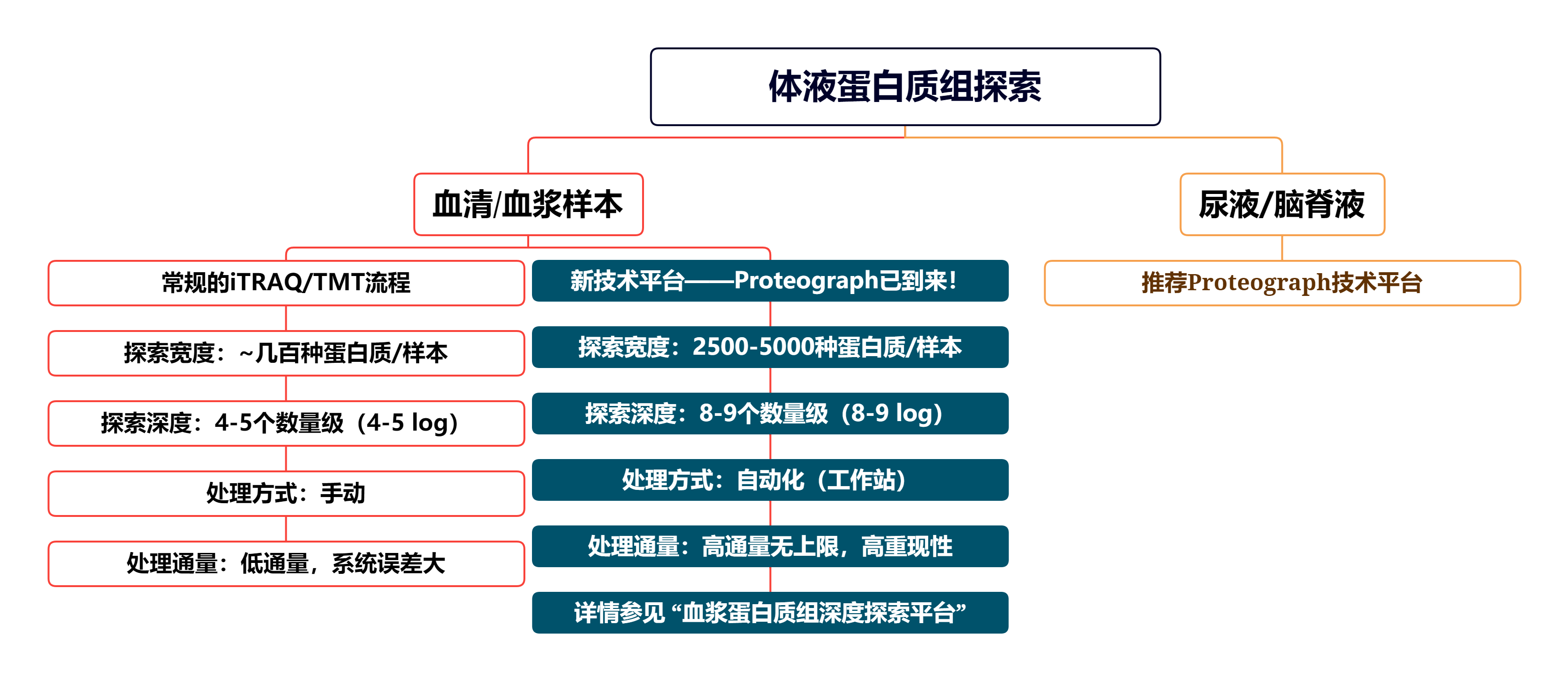
👉 ProteographTM-高深度血浆蛋白质组技术探索
参考文献:
Cell Rep 2022,38(3):110271. (6批TMT-16plex血浆样本分析,平均每批鉴定的蛋白质数目为992种,6批共同鉴定到的蛋白数目为665种)
Nature communications 2020, 11(1):3662. (ProteographTM技术平台原创文献)。