
摘要
本实验以 SYTOX Green 作为荧光探针对热激处理后死亡的秀丽线虫进行染色标记,利用高内涵成像系统自动化拍摄并分析相应的荧光图像,再以热图、散点图等形式对实验结果进行可视化呈现,便于快速、高效、直观地筛选候选样品以用于后续验证与分析。
关键词:热激,高内涵成像,秀丽线虫,高通量筛选


✦
✦
✦
研究背景
秀丽隐杆线虫(Caenorhabditis elegans,以下简称“秀丽线虫”)作为常见的模式生物之一,具有生命周期短、繁殖速度快、实验操作简单、遗传资源丰富、关键信号通路与人类同源性高等突出优点,因而是探寻疾病发生机制和构建新药筛选模型的强有力动物模型 (Kaletta and Hengartner, 2006; Kukhtar et al., 2020)。其中,秀丽线虫群体存活率是其整体健康状况和抗胁迫能力的综合表现 (Wang et al., 2014),因此,针对野生型和疾病模型建立快速、准确的存活状态鉴定方法有望在活性先导化合物发现领域得到广泛应用,其特色之一是在整体动物水平进行高效筛选。
荧光染料标记是高效鉴定秀丽线虫存活状态的重要方法。其中,SYTOX Green 染料比较容易穿过死细胞的细胞膜,然后与 DNA 结合并发出较强的绿色荧光信号 (激发波长 485 nm、发射波长 520 nm),但不能对活细胞进行染色 (Gill et al., 2003)。据此,利用高内涵成像系统分析比较单个或多个平行孔内的秀丽线虫绿色荧光面积大小可以直接检测其死亡率高低,从而快速、高效地评价受试样品增强秀丽线虫在胁迫条件下存活能力的作用。
✦
✦
✦
材料与试剂
1. 5-氟-2′-脱氧尿嘧啶核苷 FUdR (Sigma-Aldrich Trading Co. Ltd., Sigma, catalog number: F0503)
2. SYTOX Green 染料 (Life Technologies, Invitrogen, catalog number: S7020)
3. 384 孔板,方孔 (Wuxi NEST Biotechnology Co. Ltd., Nest, catalog number: 761001)
4. 耐高压的 1 L 蓝盖试剂瓶 (Thermo Fisher Scientific, FisherBrand, catalog number: FB8001000)
5. NA22 大肠杆菌和 N2 野生型秀丽线虫 (CGC, University of Minnesota, MN, USA)
6. 次氯酸钠溶液 (广州化学试剂厂, catalog number: 7681-52-9)
7. 氢氧化钠 (国药集团化学试剂有限公司, catalog number: 1310-73-2)
8. 0.5 mg/ml FUdR 母液 (见溶液配方)
9. 9 μM SYTOX Green 母液 (见溶液配方)
10. 受试样品母液 (见溶液配方)
11. 线虫裂解液 (见溶液配方)
12. S medium (见溶液配方)
13. M9 缓冲液 (见溶液配方)
✦
✦
✦
仪器设备
1. 自动化移液工作站 (Beckman Coulter, model: Biomek 4000)
2. 微模式生物自动分选系统 (Union Biometrica, model: COPAS Biosort)
3. 高内涵成像系统 (Molecular Devices, model: ImageXpress Micro)
4. 恒温培养振荡箱 (上海智城, model: ZWY-100H)
5. 多功能酶标仪 (Molecular Devices, model: SpectraMax iD5)
✦
✦
✦
实验步骤
一、秀丽线虫同步化处理
1. 取 1.5 ml EP 管收集产卵期的 N2 成虫,用 0.5 ml 的 M9 缓冲液重悬后,加入等体积新鲜配置的线虫裂解液在室温下裂解 3~5 分钟以释放虫卵。
2. 在室温和 2,000 × g 条件下离心 1 min 收集虫卵,加入 1 ml 的 M9 缓冲液重悬虫卵后再次离心收集。重复洗涤步骤 3 次。
3. 吸取 ~20 ml 的 S Medium 溶液重悬虫卵,转移至 50 ml 的无菌锥形瓶,放置于 20 °C 振荡培养箱内培养过夜以获得同步化的 L1 期幼虫。
4. 在 37 °C 过夜培养 NA22 至菌液 OD570nm 约为 0.5,然后离心浓缩 10 倍。调节秀丽线虫密度至 20~30 条 /10 μl,加入 1/10 体积的浓缩菌液作为食物,将锥形瓶放回 20 °C 振荡培养箱中继续培养 42 h 至秀丽线虫生长到 L4 期 (Guo et al., 2020)。
二、NA22 菌液配制
1. 从大肠杆菌 NA22 平板上挑取一个单菌落接种到含有 50 ml LB 液体培养基的无菌锥形瓶中,放入 37 °C 振荡培养过夜。
2. 将菌液均分转移至两个 50 ml 离心管中,在 4 °C 和 8,000 × g 条件下离心 5 min,倒出培养液,加入 5 ml 的 S Medium 重悬,配制成 10× NA22 浓缩菌液备用。
3. 分别吸取 10 μl 浓缩菌液加入到 384 孔板内 3 个含有 70 μl S Medium 的平行孔中,充分混匀后利用酶标仪在 570 nm 处读取溶液的 OD 值。通过加入(或经离心后吸出)适量的 S medium,调节 NA22 菌液浓缩程度至孔内菌液 OD570nm 约为 0.4。
三、热激实验的培养液分配
1. 按照表 1 配制热激实验所需的培养液。各孔溶液终体积为 80 μl。
2. 取步骤 1 中同步化的 L4 期 N2 秀丽线虫,经 M9 缓冲液清洗 3 次去除残留的食物,再用 COPAS Biosort 将其按照每孔 25 条定量分配至 384 孔板各孔中,以每分配一条秀丽线虫带入 1 μl 培养液的量粗略计算虫液总体积即为 25 μl (Lionaki and Tavernarakis, 2013)。
3. 秀丽线虫分配完成后,384 孔板加盖并用长条形 Parafilm 封口膜将微孔板边缘 (盖子与板底接触部位) 缠绕一圈,置于倒置显微镜下观察孔内秀丽线虫的条数及状态,若无特殊问题即可放入 20 °C 培养箱中振荡培养 2 天。
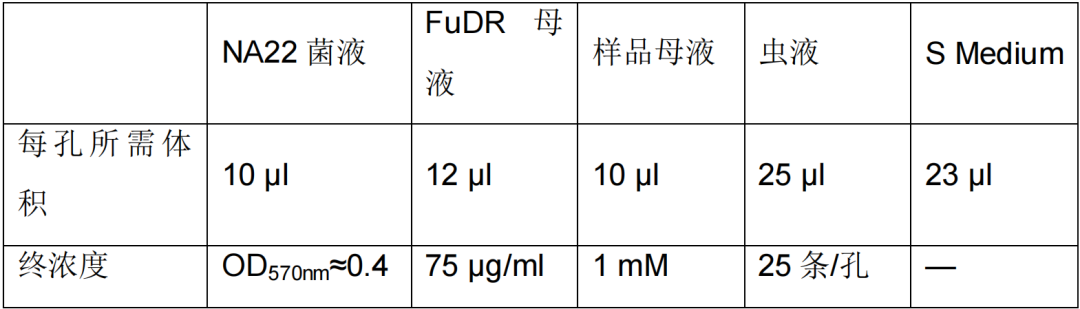
表 1. 384 孔板每孔所需的试剂体积及其终浓度
四、染色与热激处理
1. 从 -20 °C 取出 SYTOX Green 染料母液,常温下避光融化。
2. 用移液工作站分别吸取 10 μl SYTOX Green 染料母液至各孔,轻轻振荡以混匀。此时染料终浓度为 1 μM (Lionaki and Tavernarakis, 2013)。
3. 用锡箔纸将 384 孔板包裹以避光,放入 35 °C 振荡培养箱中热激处理 16 h。
五、图像获取与分析
1. 将微孔板从培养箱中取出,揭掉 Parafilm 封口膜 (不用揭开盖子),放入高内涵成像设备 ImageXpress Micro 的读板槽中,在 2x 物镜下选用绿色荧光 (FITC) 和明场(TL20%) 两个拍摄通道 (Wang et al., 2016),曝光时间分别设置为 50 s 和 60 s,选用“Laser and Image-Based Autofocusing”自动对焦模式,点击“Acquire Plate”自动拍摄各孔的明场图像和荧光图像。
2. 拍照完成后点击“Review Plate Data”,找到对应孔板编号的原始数据,利用自定义分析模块自动化分析各孔秀丽线虫 FITC图像的平均总荧光面积 (Total Area_Sum)及识别到的物体个数 (Cell Count),计算两者的乘积即为各孔秀丽线虫总荧光面积。
✦
✦
✦
结果与分析
本实验选取 L4 期秀丽线虫 N2 经给药培养 48 h 后,加入 SYTOX Green 荧光染料,并在 35 °C 高温下热激处理 16 h,使用高内涵成像系统对 384 孔板(每孔代表一个受试样品)进行图像拍摄及数据分析 (王勇超, 2020)。代表性实验结果如图 1 所示,其中图 1A 以热图形式展示了各孔内的平均总荧光面积 (Total Area_Sum),再乘以各孔识别到的物体个数 (Cell Count),可得到各孔秀丽线虫总荧光面积 (Fluorescence Area)。该数值越大,代表死亡率越高 (即为阴性结果);相反,该数值越小,代表存活率越高 (即为阳性结果)。图 1B 以散点图的形式展示了各孔对应的秀丽线虫总荧光面积大小,可根据受试样品规模及受试实验需要来设定候选样品的判定标准,如选择偏离总体平均值(黑色横实线) 50% 的上限值 (红色横虚线) 和下限值 (绿色横虚线) 为进入下一轮活性筛选的判定标准。此处我们挑选总荧光面积小于上述下限值的样品作为候选活性样品用于后续实验验证。若应用于高通量筛选的大数据分析,还可以参考使用其它的数据均一化处理方法,如 Z 评分、B 评分等 (Malo et al., 2006)。
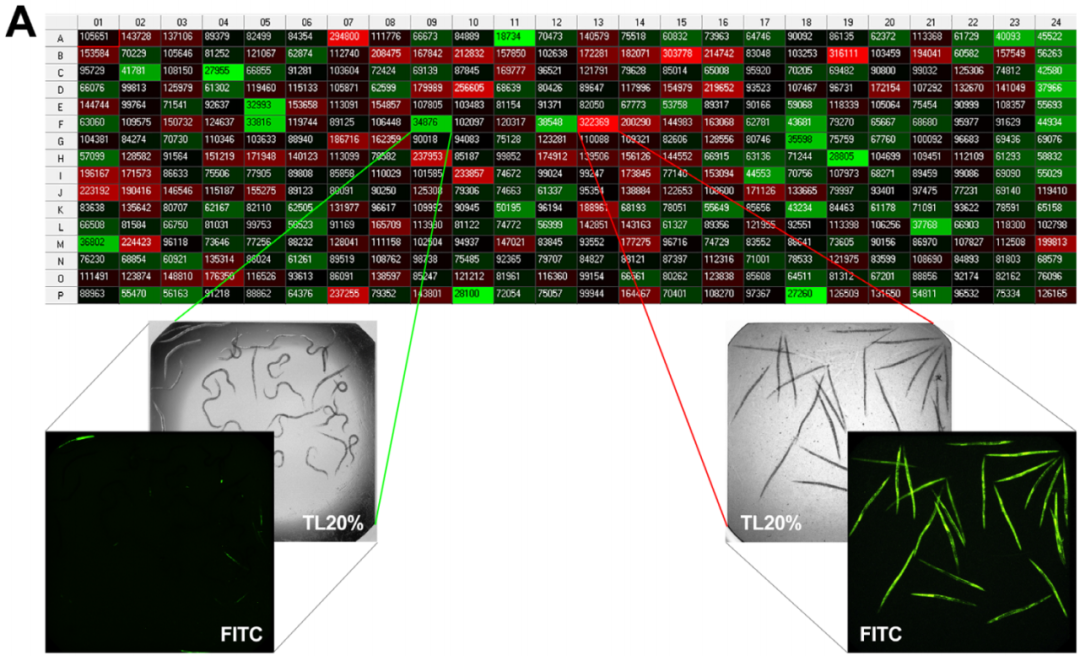
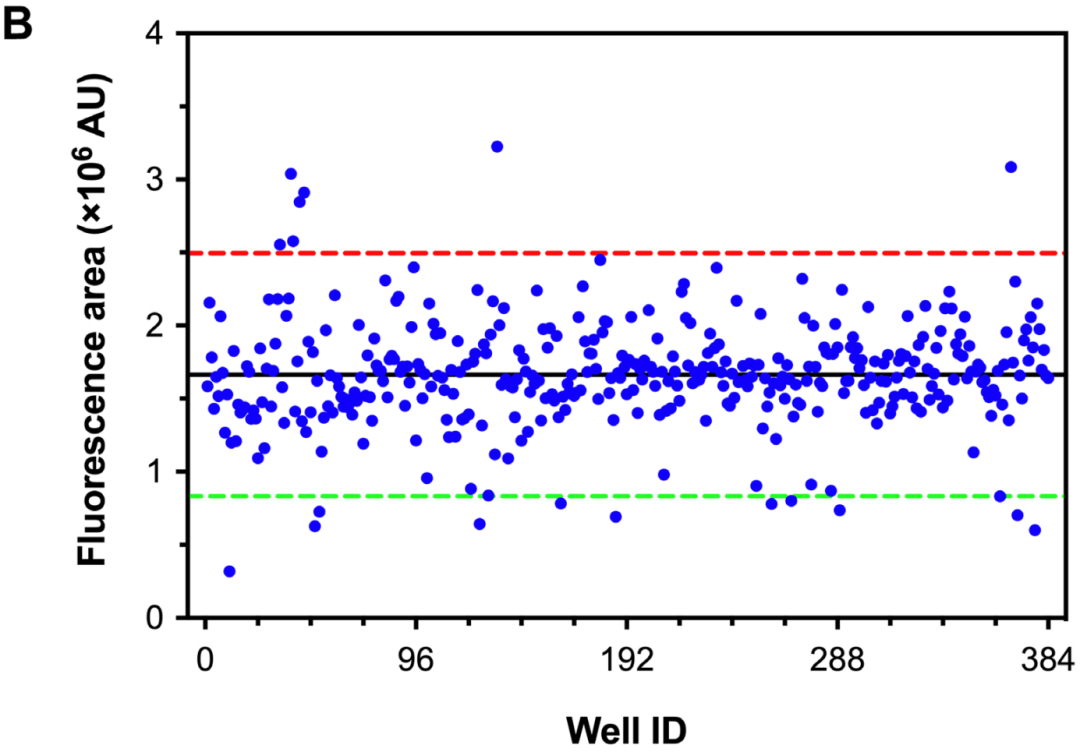
图 1. 基于高内涵成像系统检测的秀丽线虫热激存活率
✦
✦
✦
失败经验
1. 微孔板放入 35 °C 振荡培养箱进行热激处理时,应尽量避免振荡器内部风机直接吹向 384 孔板,可用硬纸片挡在在两者之间,减少吹风散热作用导致的板内各孔间的温度差异及边缘效应。
2. 由于 384 孔板的孔面积较小,孔内液体会在表面张力作用下产生四周液面高、中间液面低的现象,从侧面看孔内液面呈 U 型。这种现象会影响明场通道 (TL20%) 透射光的路径,导致高内涵成像系统拍摄出来各孔明场图像的周边颜色较暗而中央部位较明亮,但并不影响 FITC 通道荧光图像的检测结果。实验结果表明适当增加孔内溶液体积可减弱这种干扰现象,推荐 80~100 μl 作为每孔溶液的终体积大小。
3. SYTOX Green 染料在使用过程中要注意避光,从而减少受试样品溶液背景荧光(噪声) 干扰。
✦
✦
✦
溶液配方
1. 0.5 mg/ml FUdR 母液
精确称取 25 mg FUdR 于 50 ml 离心管中,加入 50 ml S Medium 使其充分溶解,经 0.22 μm 无菌滤膜滤过后,分装至 EP 管并于 -20 °C 保存备用。
2. 9 μM SYTOX Green 母液
在避光条件下精确吸取 5 mM SYTOX Green 试剂原液 18 μl,与 10 ml S Medium 充分混合均匀,分装至 2 ml 离心管,用锡箔纸包裹管外壁以避光,于 -20 °C 保存备用。
3. 受试样品母液
可根据受试样品所需的浓度将其用 S Medium 配制为 8 mM 母液,经 0.22 μm 无菌滤膜过滤后分装至 EP 管,于 -20 °C 保存备用。
4. 线虫裂解液
吸取等体积的 NaOCl 溶液和 1 M NaOH 溶液混合均匀,现配现用。
5. 1 M 柠檬酸钾溶液
分别称取 10.0 g 柠檬酸一水合物和 146.75 g 柠檬酸钾一水合物装进 1 L 的耐高压蓝盖试剂瓶中,加入 1 L 去离子水,121 °C 高压灭菌 30 min。冷却后室温保存。
6. 微量元素溶液
分别称取 1.86 g 乙二胺四乙酸二钠,0.69 g FeSO4·7H2O,0.2 g MnCl2·4H2O,0.29g ZnSO4·7H2O,0.025 g CuSO4·5H2O,装进 1 L 的耐高压蓝盖试剂瓶中,加入 1L 去离子水,121 °C 高压灭菌 30 min。冷却后避光室温保存。
7. S medium
分别称取 5.85 g NaCl,6.0 g KH2PO4 和 1.0 g K2HPO4 装进 1 L 的耐高压蓝盖试剂瓶中,加入 973 ml 去离子水,121 °C 高压灭菌 30 min。室温下冷却至 ~60 °C 后,依次加入 1 ml 5 mg/ml 胆固醇的无水乙醇溶液,3 ml 无菌的 1 M CaCl2 溶液,3 ml无菌的 1 M MgSO4 溶液,10 ml 无菌的 1 M 柠檬酸钾溶液,10 ml 无菌的微量元素溶液。室温保存。
8. M9 缓冲液
分别称取 5.0 g NaCl,3.0 g KH2PO4 和 6.0 g Na2HPO4 装进 1 L 的耐高压蓝盖试剂瓶中,加入 1 L 去离子水,121 °C 高压灭菌 30 min。室温下冷却至 ~60 °C 后,加入 1 ml 无菌的 1 M MgSO4 溶液。室温保存。

参考文献
1. 王勇超. (2020). 基于秀丽线虫模型的抗热休克活性菌株高通量筛选研究 广东药科大学.
2. Gill, M. S., Olsen, A., Sampayo, J. N. and Lithgow, G. J. (2003). An automated high-throughput assay for survival of the nematode Caenorhabditis elegans. Free Radic Biol Med 35(6): 558-565.
3. Guo, K., Su, L., Wang, Y., Liu, H., Lin, J., Cheng, P., Yin, X., Liang, M., Wang, Q. and Huang, Z. (2020). Antioxidant and anti-aging effects of a sea cucumber protein hydrolyzate and bioinformatic characterization of its composing peptides. Food Funct 11(6): 5004-5016.
4. Kaletta, T. and Hengartner, M. O. (2006). Finding function in novel targets: C. elegans as a model organism. Nat Rev Drug Discov 5(5): 387-398.
5. Kukhtar, D., Rubio-Peña, K., Serrat, X., and Cerón, J. (2020). Mimicking of splicing-related retinitis pigmentosa mutations in C. elegans allow drug screens and identification of disease modifiers. Hum Mol Genet 29(5): 756-765.
6. Lionaki, E. and Tavernarakis, N. (2013). High-throughput and longitudinal analysis of aging and senescent decline in Caenorhabditis elegans. Methods Mol Biol 965: 485-500.
7. Malo, N., Hanley, J. A., Cerquozzi, S., Pelletier, J. and Nadon, R. (2006). Statistical practice in high-throughput screening data analysis. Nat Biotechnol 24(2): 167-175.
8. Wang, Q., Yang, F., Guo, W., Zhang, J., Xiao, L., Li, H., Jia, W. and Huang, Z. (2014). Caenorhabditis elegans in Chinese medicinal studies: making the case for aging and neurodegeneration. Rejuvenation Res 17(2): 205-208.
9. Wang, Q., Huang, Y., Qin, C., Liang, M., Mao, X., Li, S., Zou, Y., Jia, W., Li, H., Ma, C. W. and Huang, Z. (2016). Bioactive peptides from Angelica sinensis protein hydrolyzate delay senescence in Caenorhabditis elegans through antioxidantactivities. Oxid Med Cell Longev 2016: 8956981.
