
* 文章来源于 Bio-protocol
摘要
DNA 双链断裂 (double-strand break, DSB) 是最致命的 DNA 损伤类型之一。DNA 损伤发生后,细胞发生 DNA 损伤应答,某些 DNA 损伤应答蛋白在 DSB 发生处积累和/或修饰,而产生核内点状 foci。通过免疫荧光或荧光蛋白标记法可在荧光显微镜下观察到 foci。观察核内 foci 的形成,已成为评价 DNA 损伤的敏感且常用的方法,并且被应用于生物辐射暴露剂量测定 (Mah et al., 2010)、个人辐射敏感性评估 (Lee et al.,2016) 和毒性评估 (Markova et al., 2005; Armand et al., 2016)等。可通过分析核内 foci,并计算平均每个核的 foci 个数或平均 DNA面积的 foci 个数 (Qvarnstrom et al., 2004),来量化 DNA 双链断裂的程度。
形成 foci 的 DNA 损伤应答蛋白包括 H2AX、53BP1、RAD51、MRE11/RAD50/NBS1 复合物等 (Rothkamm et al., 2015)。真核生物主要以同源重组 (homologous recombination, HR) 和非同源末端连接 (nonhomologous DNA end joining, NHEJ) 这两种途径来修复 DSB,而 53BP1 是 NHEJ 修复途径的重要一员 (Panier et al., 2014)。
本研究拟采用稳定转染 EGFP-53BP1 (1220~1711 aa) 融合蛋白的 HeLa 细胞系,采用 X 射线辐照诱导细胞发生 DSB,原本倾向于弥散分布的 EGFP-53BP1 (1220~1711aa) 在辐照后被招募到 DSB 附近,表现为核内 foci 增加。Amifostine 是 FDA 批准的具有放射防护功效的药物,WR-1065 是它的代谢产物,被报道可以抑制辐射诱导的 DSB 产生,减少辐射诱导的 53BP1 foci (Hofer et al., 2016),被用作该细胞模型的参考化合物。采用该模型,考察化合物对核内 foci 数量的影响,为化合物毒性或 DNA 损伤的治疗提供新的思路。
关键词:53BP1,foci,DNA 双链断裂,DNA 损伤
材料与试剂
序号 | 材料/试剂名称 | 品牌/公司 | 货号 |
1 | 高糖 DMEM 基础培养基 | CORNING | 养基 CORNING 10-013-CV |
2 | 胎牛血清 | CORNING | 35-015-CV |
3 | 双抗 | CORNING | 30-002-CIa |
4 | 胰酶 | CORNING | 25-051-CI |
5 | Puromycin dihydrochloride, 嘌呤霉素盐酸盐 | 上海翌圣 | 60210ES25 |
6 | 台盼蓝 | Invitrogen | 60210ES25 |
7 | DMSO | SIGMA-ALDRICH | 276855 |
8 | Polybrene | 云舟生物 | VectorBuilder |
9 | WR-1065 dihydrochloride, WR-1065 盐酸盐 | MedChemExpress (MCE) | HY-103640 |
10 | 4% 多聚甲醛固定液 | 上海生工 | E672002 |
11 | Hoechst 33342 | Invitrogen | H1399 |
12 | PBS 缓冲液干粉 | 北京索莱宝 | P1010 |
13 | 无菌 PBS | 江苏凯基生物 | KGM20012-2 |
14 | 25 cm^2 细胞培养瓶 | CORNING | 430639 |
15 | 75 cm^2 细胞培养瓶 | CORNING | 430641 |
16 | 黑色底透 96 孔细胞培养板(TC 处理) | CORNING | 3904 |
17 | 12 孔细胞培养板(TC 处理) | 无锡耐思生物NEST | 712001 |
18 | 透明 96 孔细胞培养板(TC 处 理) | 无锡耐思生物NEST | 701001 |
仪器设备
序号 | 仪器名称 | 品牌/公司 | 型号 |
1 | 二氧化碳培养箱 | Thermo Scientific | Thermo Forma 3111 Water Jacketed CO2 Incubator |
2 | 二级生物安全柜 | Thermo Scientific | 1300 SERIES A2 |
3 | 自动细胞计数仪 | Thermo Scientific | Invitrogen Countess 3 |
4 | 倒置荧光显微镜 | Leica | DMi3000 B |
5 | 纯水系统 | 上海安亭科学仪器 厂 | 飞鸽牌离心机 TDL-40B |
6 | 纯水系统 | ELGA LabWater, UK | ELGA PURELAB flex system |
7 | X 射线生物辐照仪 | Rad Source | RS2000 |
8 | 高内涵成像系统 | Molecular Devices | ImageXpress PICO |
实验步骤

细胞培养
1. HeLa 细胞的培养:采用高糖 DMEM 完全培养基,于 5% 二氧化碳、37 °C 的二氧化碳培养箱中培养。根据实验所需的细胞数量,贴壁培养在 25 cm^2 或 75 cm^2 细胞培养瓶中。细胞在培养瓶中增殖,当用倒置显微镜观察到细胞密度达到 80% 左右时,采用胰酶将细胞消化解离,再接种一小部分到培养瓶中,传代培养;或接种到孔板中进行转染或辐照实验。每 3 天左右进行一次传代。高糖 DMEM 完全培养基的配方详见“溶液配方”部分。胰酶消化、接种到孔板的操作于二级生物安全柜中进行,步骤详见“三、细胞种板、化合物预处理、辐照”部分。
2. HeLa-EGFP-53BP1 细胞的培养:在培养瓶中培养时,在高糖 DMEM 完全培养基中额外添加 2 μg/ml 嘌呤霉素盐酸盐。除此之外,培养方式与 HeLa 细胞相同(接种到孔板进行实验时,也并不额外添加嘌呤霉素盐酸盐)。嘌呤霉素盐酸盐的配制详见“溶液配方”部分。

细胞转染
1. 构建基因表达慢病毒载体、收集病毒:人 TP53BP1 基因 (全长 1972 aa) 的1220~1711 aa 是它的最小 focus 形成区 (Panier et al., 2014),将 EGFP 与人 TP53BP1 的 1220~1711 aa 基因序列直接连接,构建 EGFP-53BP1(1220~1711 aa)的基因表达慢病毒载体。转染 HEK 293T 细胞产生慢病毒颗粒。委托云舟生物公司进行基因表达慢病毒载体的构建和慢病毒颗粒的收集,载体图谱如图 1 所示。该载体携带嘌呤霉素抗性,转染细胞之后,通过在培养时加入嘌呤霉素,选择性杀死未感染的细胞。

图 1. EGFP-53BP1(1220~1711aa)的基因表达慢病毒载体
2. 确定嘌呤霉素浓度:将 HeLa 细胞消化,以高糖 DMEM 完全培养基重悬,2000 个细胞/孔接种于透明 96 孔细胞培养板,贴壁后给以 100 μl/孔的 0.5~10 μg/ml 嘌呤霉素盐酸盐。每两天更换一次新的嘌呤霉素盐酸盐,观察 4 天。选取在嘌呤霉素盐酸盐孵育 4 天时能够杀光孔内全部细胞的最低浓度,为最佳浓度。种板步骤参见“三、细胞种板、化合物预处理、辐照”部分。
3. 转染:以慢病毒转染 HeLa 细胞,以获得 HeLa-EGFP-53BP1 稳定转染细胞系。转染前一天,接种细胞于 12 孔细胞培养板,使得第二天细胞密度为 50% 左右。转染当天,观察确认细胞密度适宜后,加入病毒和 Polybrene,以感染细胞。Polybrene 的终浓度为 5 μg/ml。所需加入的病毒体积如下计算。取一孔进行细胞计数。MOI(Multiplicity of Infection,感染复数)是指每个细胞感染的病毒个数。所需病毒个数=转染时细胞数* MOI,所需加入的病毒体积=病毒个数/病毒滴度。HeLa 的 MOI 参考值在 10~30,通过预实验摸索最佳的 MOI 值,如将 MOI 设为 10、30、100,选择能达到较好感染效率的最小 MOI,即为最佳 MOI 值。感染后 8 h,吸去含病毒和 Polybrene 的培养基,换上新鲜的高糖 DMEM 完全培养基继续培养。感染后 48 h,倒置荧光显微镜的 FITC 通道下可观察到核内绿色荧光,如图 2。换上含 2 μg/ml 嘌呤霉素盐酸盐的高糖 DMEM 完全培养基,继续培养。细胞消化、计数步骤参见“三、细胞种板、化合物预处理、辐照”部分。
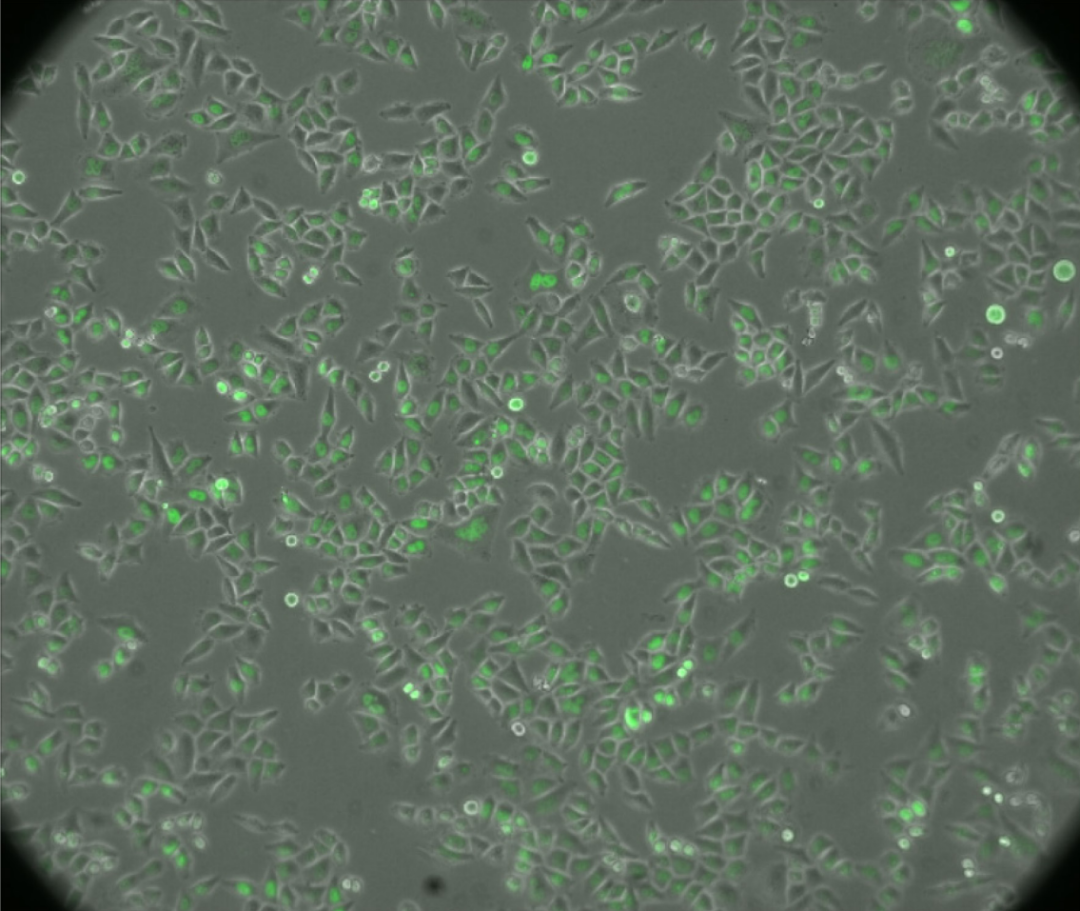
图 2. 感染后的细胞(透射光与绿色荧光的叠加)

细胞种板、化合物预处理、辐照
1. 细胞种板:弃去培养瓶中的培养基,把细胞用 2 ml 无菌 PBS 清洗一遍,再加入胰酶溶液(75 cm^2 培养瓶加 2 ml 胰酶,25 cm^2 培养瓶加 1 ml 胰酶),使胰酶布满细胞所贴附的瓶底,于 37 °C 培养箱中孵育约 1 min,以促使细胞脱离贴壁状态。1 min 后从培养箱拿出,显微镜下观察到细胞已从贴壁伸展状态变为即将脱离的圆形状态,代表胰酶作用时间足够,则立刻加 3 倍于胰酶体积的高糖 DMEM 完全培养基,以终止胰酶的作用。吹打瓶底以确保细胞完全脱离瓶底。将含细胞的胰酶、高糖 DMEM 完全培养基混合液全部转移到 15 ml 离心管中,900 rpm 离心 5 min,然后去除上清,将细胞沉淀用 3~5 ml 高糖 DMEM 完全培养基重悬。取 10 μl 细胞悬液,与 10 μl 台盼蓝溶液混合,再吸取 10 μl 混合液打入细胞计数仪配备的计数板,插入细胞计数仪进行自动计数,以得知活细胞浓度(个/ml)。再用高糖 DMEM 完全培养基将细胞悬液稀释成 5 万个活细胞/ml,以 100 μl/孔接种在黑色底透 96 孔细胞培养板中,则每孔接种了 5000 个活细胞。选用的黑色底透 96 孔细胞培养板,表面是 tissue-culture(TC)处理,可以让细胞贴附;孔壁为黑色,以防止孔间荧光干扰,底为较薄的透明平底以满足高内涵成像仪器的自动对焦需求。设置不接受辐照的板和接受辐照的板。正常对照组安排在不接受辐照的板上。辐照组、化合物处理组安排在接受辐照的板上。
2. 化合物预处理、辐照:细胞贴壁后,对各实验组进行如下处理。
(1) 辐照组即 IR 组:设置在接受辐照的板上。在辐照前 30 min,将辐照组孔内液体换成 100 μl 高糖 DMEM 完全培养基。
(2) 化合物预处理组:设置在接受辐照的板上。用高糖 DMEM 完全培养基将 WR- 1065 盐酸盐或待测化合物从储备溶液稀释成指定浓度。在辐照前 30 min,将孔内液体用移液器小心吸去,换成 100 μl/孔的含化合物的高糖 DMEM 完全培养基,使孔内细胞在辐照之前,与化合物溶液预先孵育 30 min。
(3) 正常对照组即 Control 组:设置在不接受辐照的板上。在辐照板接受辐照之前 30 min,将正常对照组孔内液体换成 100 μl 高糖 DMEM 完全培养基。
将辐照组和化合物处理组所在的板放入辐照仪中,暴露于 X 射线辐照 (50 s=1 Gy)。而正常对照组所在的板不接受辐照。辐照后将细胞再放回二氧化碳培养箱中孵育 2 h,随后对上述实验组进行同样的固定、染色操作。

细胞固定、细胞染色、图像采集
1. 细胞固定、细胞染色:弃去培养液,向孔内加入 100 μl 室温的 4% 多聚甲醛溶液,在室温下静置 10 min 以固定细胞。将“加入 100 μl PBS/孔,再吸去”计为用 PBS 洗涤 1 次。弃去多聚甲醛溶液,将细胞用 PBS 洗涤 2 次。然后,弃去 PBS,加入 100 μl 1 μg/ml Hoechst 33342,在室温下静置 10 min,以对细胞核染色。将染色后的细胞用 PBS洗涤 3 次。最后,将 100 μl PBS 添加到每个孔中,避免细胞干燥。去除液体的操作都以移液器小心去除,吸头尖部顶住孔底最边缘,尽量避免吸头碰到细胞。加液操作都以移液器小心加入,吸头尖部顶住孔内侧壁,沿壁打入液体,尽量避免液体冲击细胞。固定染色后的样品板在 4 °C 可储存 1 个月。由于荧光染料 Hoechst 33342 需要避光,从涉及 Hoechst 33342 的步骤开始到成像完毕,都避光操作。
2. 图像采集:将样品板恢复至室温,用无尘纸以按压法轻轻擦拭板的底部,以擦去板底上可能存在的影响成像的水汽或灰尘。擦拭力度轻,以防止擦出划痕,影响成像。将擦拭后的样品板放入 ImageXpress PICO 高内涵成像系统的舱中,选择 40 倍物镜,添加 DAPI 通道和 FITC 通道,调节曝光时间和焦距后,批量拍摄,每个孔拍摄 6 到 12 个视野。图 3 中,正常对照组 (Control) 内,更多的细胞核内 EGFP-53BP1 (1220~1711 aa)融合蛋白弥散分布或仅有少量的 foci;辐照组 (IR) 内,融合蛋白大多聚集成 foci;参考化合物 WR1065 盐酸盐 (WR1065 2HCl) 的预处理减缓了辐照带来的 foci 增多现象。

图 3. 正常对照组 (Control)、辐照组 (IR)、参考化合物组 (IR + WR1065 2HCl)的代表性图片

图像分析
1. 打开高内涵系统配套软件,添加分析操作。选择软件提供的分析模块:Autophagy 分析模块、Internalization 分析模块或 Lysosomal degradation 分析模块均可。这三种分析模块具有同样的分析逻辑,即:先用核染色通道图片识别细胞核所在位置,再用另一个染色通道图片识别颗粒所在位置;三者均能够适用于分析核内 foci 的情景。
2. 更改分析模块内的参数。首先,Nuclear Channel 选择 DAPI,调整 Intensity above background、Min width 和 Max width,使得软件能正确识别到核的位置。其次,Granule Channel 选择 FITC,调整 Intensity above background、Min width 和 Max width,使软件能正确识别到核内 foci 的位置。预览分析效果时,软件会自动展示其所识别到的细胞核、核内颗粒、核外颗粒的位置。可通过单击对应图标取消展示,再次单击对应图标重新展示,以将软件识别效果与原荧光图进行对比,方便调整分析模块参数。
3. 运行分析,软件自动分析完成后,导出 ExperimentSummaryData.csv 文件,比较正常组、辐照组、化合物处理+辐照组的平均颗粒个数。平均颗粒个数 Avg Granule Count = Total Granule Count/Total Object Count。由于平均数会受到少数特大或特小的数据影响,所以可以计算 foci ≥ 20 的细胞在总细胞中的占比 (%),作为更具有代表性的指标。导出 ExperimentCellData.csv 文件,求每个孔内 foci ≥ 20 的细胞个数,除以该孔的总细胞数,相除即得到 foci ≥ 20 的细胞在总细胞中的占比 (%)。
结果与分析

图 4. Foci 水平随辐照剂量和参考化合物浓度的变化
由图 4 可见, foci 水平随着辐照剂量(0.5 Gy,1.0 Gy,2.0 Gy)的升高而升高。而随着参考化合物 WR-1065 2HCl 浓度的升高,foci 水平逐渐下降。这符合辐照诱导 DSB 产生,而 WR-1065 抑制 DSB 产生的事实。
选择 foci ≥ 20 的细胞在总细胞中的占比,来代表 foci 水平,原因如下。计算了 foci ≥ 5 细胞占比、foci ≥ 10 细胞占比、foci ≥ 20 细胞占比、foci ≥ 30 细胞占比,比较发现,若采用 foci ≥ 5 细胞占比、foci ≥ 10 细胞占比,则无法区分不同剂量辐照的实验组;而若采用 foci ≥ 30 细胞占比,则在 0.5 Gy 剂量辐照下,无法很好地显示出不同浓度参考化合物(WR1065 2HCl)的量效差异(图 5)。采用 foci ≥ 20 细胞占比作为 foci 水平的指标,显示出了辐照剂量以及参考化合物浓度对细胞群体 foci 水平的剂量依赖性的影响。
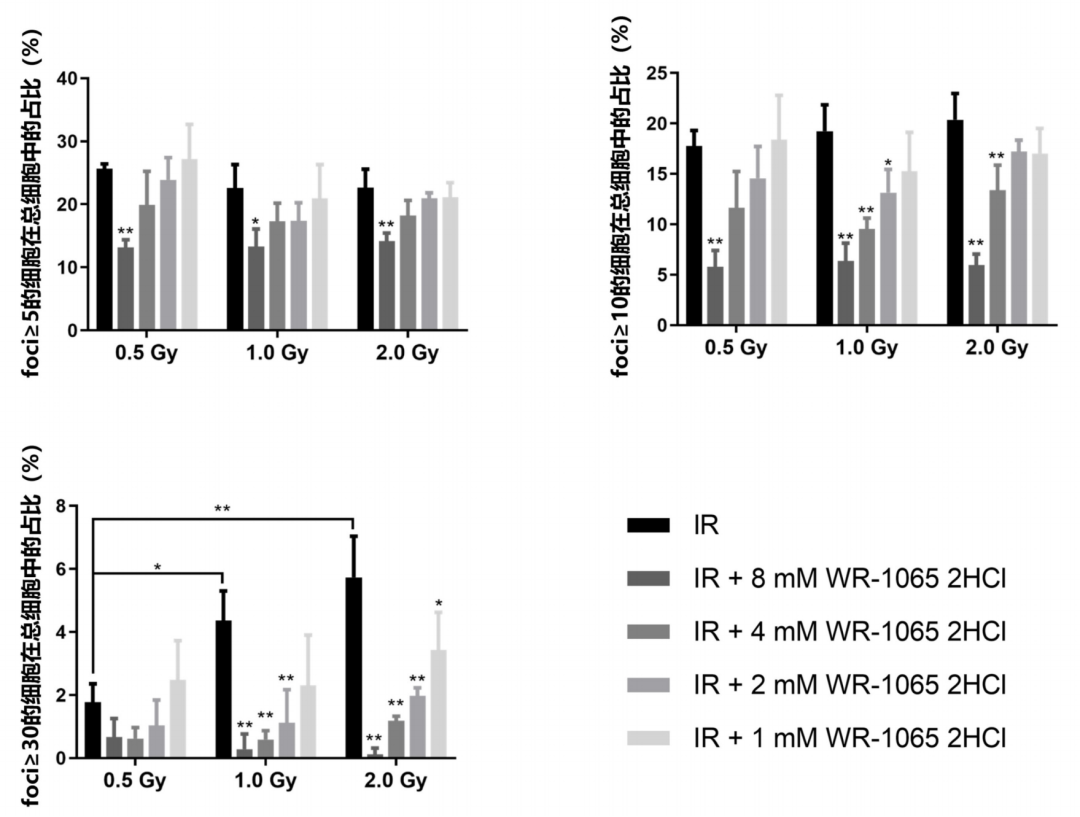
图 5. Foci ≥ 5 细胞占比、foci ≥ 10 细胞占比、foci ≥ 30 细胞占比
该细胞模型能够用于毒性试剂、DNA 损伤保护试剂的高通量评估。若不给以辐照,仅给以化合物处理就能提高 foci 水平,则该化合物可能有着诱导 DSB 的毒性。若给细胞进行辐照前的化合物预处理,“化合物预处理+辐照”组相比于辐照组,foci 水平有所降低,那么可以结合中性彗星实验进一步确认该化合物是否有 DNA 损伤防护能力。Foci 水平代表着正在进行的 NHEJ 修复,因此,foci 水平与 DSB 程度存在间接关系。而中性彗星实验作为 DSB 的金标准,虽然步骤较为繁复,但彗星尾长等指标与 DSB 程度存在直接关系。若用中性彗星实验确证了化合物预处理能降低 DSB,那么该化合物可能有抗 DNA 损伤潜力;进一步收集多个时间点的彗星实验数据,观察 DSB-时间曲线,则能确认化合物是抑制了 DSB 的产生还是促进了 DSB 修复的加快。
该方案可用于定量评估基于 NHEJ 修复途径的 DNA 损伤,但无法评估可能存在的基于 HR 修复途径的 DNA 损伤,可另外通过观察 Rad51 foci 来评估基于 HR 修复途径的 DNA 损伤。
该方案采用高内涵成像系统自带的分析软件进行 foci 的识别和计数,分析较为方便,而且可以实现边拍摄边分析,节省时间。但同时也存在着以下弊端:(1)在导出数据时,只能输出 Granule count 的值,无法单独输出 Granules on nuclei 和 Granules outside nuclei 的值,当背景噪声过大时,会识别到我们所不期望的 Granules outside nuclei,使总体的 Granule count 比实际值偏高。(2)有些细胞观察不到绿色荧光,这些细胞不能给出 53BP1 的分布信息,所以应该被排除在统计之外,但是软件难以实现排除这些细胞的功能。因此在实验中,尽量使用传代次数<10 的细胞,避免 EGFP-53BP1 的丢失;在拍摄时,注意调节曝光时间,以达到最佳的图片信噪比,减少背景噪声的干扰。
溶液配方

高糖 DMEM 完全培养基
89%(v/v)高糖 DMEM 基础培养基 +10%(v/v)胎牛血清 +1%(v/v)双抗,保存于 4 °C,2 周内使用完毕。

嘌呤霉素盐酸盐溶液
用去离子水配制为 10 mg/ml 的储备液,用 0.22 μm 微孔滤膜过滤后,分装,-20 °C 可储存 1 个月。

WR-1065 盐酸盐溶液
用去离子水配制为 400 mM 的储备液,用 0.22 μm 微孔滤膜过滤后,分装,-20 °C 可储存 1 个月。

待测化合物溶液
用 DMSO 配制为 100 mM 的储备液,分装,-80 °C 可储存 6 个月。

PBS 溶液
按试剂说明书,取 1 袋 PBS 缓冲液干粉,加去离子水定容到 2 L,完全溶解后使用,室温下可储存 2 周。本方案中,细胞固定染色过程涉及到的 PBS 均为该 PBS 溶液。

Hoechst 33342 溶液
避光配制、储存、使用。用去离子水配制为 10 mg/ml 的储备液,分装,4 °C 可储存 6 个月。临用时用 PBS 稀释成 1 μg/ml 的工作液。
致谢
实验方案改编自 Chen et al., (2020)。感谢浙江大学药物信息学研究所-Molecular Devices 高内涵成像联合实验室的设备支持。该项目受国家自然科学基金 (项目编号 81822047)的支持资助,感谢国家中医药管理局“组分中药与智能制造”多学科交叉团队的支持。
参考文献

关于美谷分子仪器
Molecular Devices 始创于上世纪 80 年代美国硅谷,并在全球设有多个代表处和子公司。2005 年,Molecular Devices 在上海设立了中国代表处,2010 年加入全球科学与技术的创新者丹纳赫集团,2011 年正式成立商务公司:美谷分子仪器 (上海) 有限公司。Molecular Devices 以持续创新、快速高效、高性能的产品及完善的售后服务著称业内,我们一直致力于为客户提供在生命科学研究、制药及生物治疗开发等领域蛋白和细胞生物学的创新性生物分析解决方案。