
现代药物发现领域主要采用两种互补的研究策略——基于靶点的药物发现 (Target-based drug discovery, TDD) 和基于表型的药物发现 (Phenotypic drug discovery, PDD) 。这两种方法各具特色:
TDD 从明确的疾病相关靶点出发,通过理性设计开发特异性调节剂;
而 PDD 则直接从细胞或组织水平的表型变化入手,无需预先了解具体作用靶点,更注重药物的整体功能效应。
在这一背景下,高内涵筛选 (High-content screening, HCS) 技术成为连接两种策略的重要桥梁。高内涵技术通过高分辨率细胞成像与多参数分析,在保持细胞完整性的同时,可全面评估化合物对细胞形态、生长、分化、迁移、凋亡等多个维度的综合影响。这种“全景式”的检测能力,使研究人员能够在单次实验中同步获取化合物的多靶点作用信息,从系统生物学层面理解药物的作用机制和潜在毒性,大大提高了药物早期评价的效率和可靠性。
那么,这项突破性技术如何推动实际药物研发?让我们通过两个案例,具体了解高内涵技术如何帮助科学家发现具有临床转化价值的新药候选物。

利用高内涵筛选发现一种小分子化合物可恢复 AP-4 相关遗传性痉挛性截瘫神经元模型中 AP-4 依赖性蛋白运输功能[1]
AP-4-HSP 是一种罕见的儿童期发病的神经退行性疾病,由 AP-4 复合体亚基功能缺失引发,导致自噬关键蛋白 ATG9A 在高尔基体(TGN)异常积累,进而影响神经元轴突功能与自噬通路,目前该病缺乏有效疗法。本文作者通过高通量筛选技术,成功鉴定出一种小分子化合物 BCH-HSP-C01,可有效恢复 AP-4 缺陷导致的蛋白运输异常,为治疗 AP-4 相关遗传性痉挛性截瘫(AP-4-HSP)提供了新思路。
研究团队首先构建了基于患者成纤维细胞的高内涵筛选平台,以 ATG9A 的 TGN / 细胞质分布比为核心指标,从 28,864 个小分子库中筛选出 503 个有效化合物。
通过剂量依赖性验证和正交实验(如 SH-SY5Y 神经母细胞瘤模型和患者诱导多能干细胞分化的神经元模型),最终确定 BCH-HSP-C01 为最优候选分子。该化合物在神经元中显著降低了 ATG9A 和另一 AP-4 运输蛋白 DAGLB 的 TGN 滞留,并恢复轴突中 ATG9A 囊泡密度,且无明显细胞毒性。
机制研究表明,BCH-HSP-C01 通过调节囊泡运输相关通路发挥作用。
转录组与蛋白质组学分析显示,该分子下调 RAB3C 和 RAB12 蛋白表达,同时上调囊泡运输调控因子 RAB1B 及转运蛋白 TFRC。
敲除实验进一步证实 RAB3C 和 RAB12 的缺失可增强 BCH-HSP-C01 对 ATG9A 运输的促进作用。此外,该化合物还通过提升自噬通量(LC3-II/I 比例增加)改善 AP-4 缺陷细胞的病理表型,且该效应依赖于自噬-溶酶体通路的完整性。
本研究使用 Molecular Devices 公司的 ImageXpress Micro Confocal 共聚焦高内涵成像分析系统,借鉴 Behne 等人报道过的自动化图像分析平台,进行小分子化合物高通量筛选。其创新性在于将疾病表型(ATG9A 错误定位)转化为可量化筛选指标,结合多组学技术解析药物机制,为罕见神经遗传病的药物开发提供了范式。

图 1:自动化图像分析平台流程图
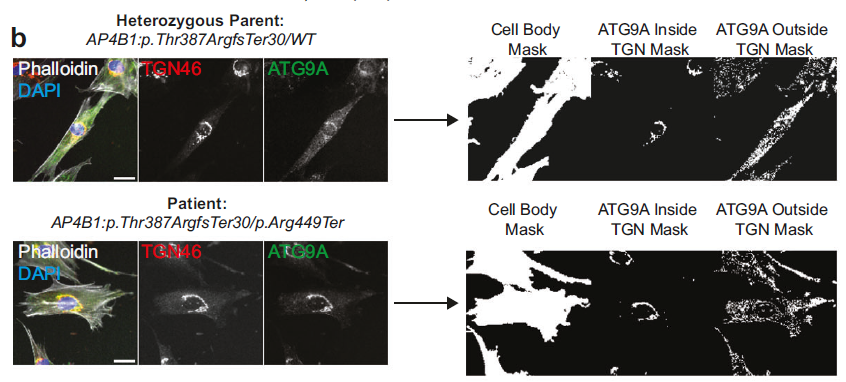
图 2:患者成纤维细胞(阴性对照,LoF/LoF)及其性别匹配的杂合子亲本(阳性对照,WT/LoF)荧光图像

基于患者来源类器官的功能性筛选鉴定出 MCLA-158:一种针对上皮性肿瘤具有治疗效力的 EGFR×LGR5 双特异性抗体[2]
由于类器官技术具有时间短、生理相关度高等优势,近年来备受药物筛选科学家的青睐。本研究利用来自多种上皮肿瘤的患者源类器官(PDOs)作为体外药物筛选平台,从亲和力、稳定性、配体阻断活性等方面鉴定出超过 500 个 WNT×RTK 双特异性抗体(bAbs),对 500 多种 bAbs 进行功能评价,寻找能够有效抑制肿瘤干细胞而不损伤正常干细胞的候选药物。科学家们发现了一种双特异性抗体(bAbs)MCLA-158 ,能够同时靶向 WNT 和 RTK 信号通路,特异性地识别并降解 EGFR,从而抑制肿瘤干细胞的生长和存活,但对正常的结肠干细胞几乎没有毒性。在体外和体内模型中,MCLA-158 均可以有效地阻断肿瘤转移起始、延缓复发、并且抑制原发肿瘤的生长。
使用 ImageXpress 高内涵细胞成像分析系统(Molecular Devices),通过全自动高速显微成像,快速捕获类器官的图像,并通过 MetaXpress 图像分析软件,对类器官的形态变化、标志物表达、生长抑制率等参数进行量化分析。结果显示 MCLA-158 处理后,EGFR 与抗体共定位并呈点状分布在胞浆内,这表明 MCLA-158 可以将 EGFR 内化。通过高内涵成像系统,研究人员发现 MCLA-158 能够特异性地识别并降解 EGFR,而且可以抑制 LGR5 标志的肿瘤干细胞的生长和存活。并且,MCLA-158 抗体不会干扰健康细胞的功能,这对维持组织的正常功能是至关重要的。
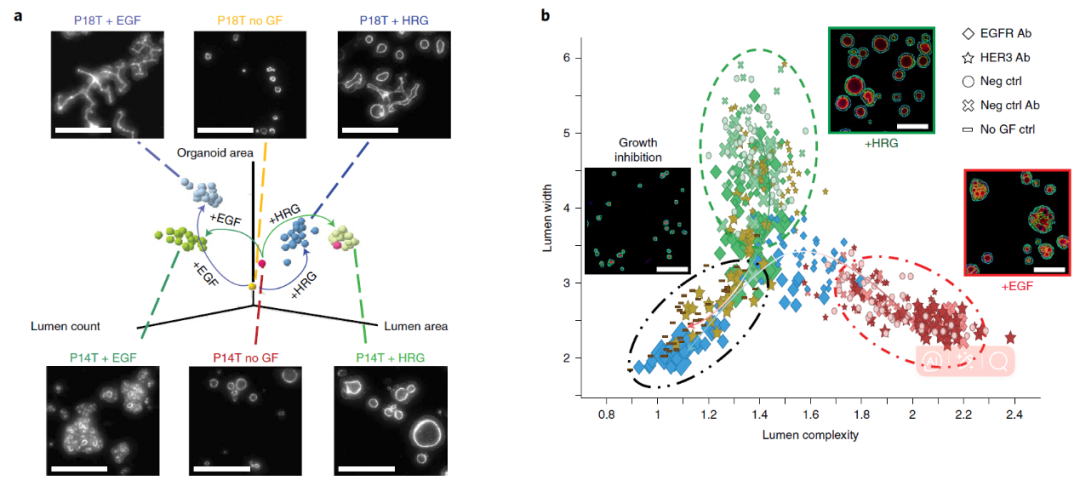
图 3:利用高内涵实现以患者源性类器官为基础(PDOs)的双特异性抗体(bAbs)的筛选
在科学技术的不断革新之下,还有很多前沿方法被用于新药研发的前期高通量筛选,通常都涉及自动化、微型化以及大规模数据分析,这些技术能够助力高效、便捷地筛选出目标靶点和更为优越的苗头化合物等,实现小分子药物开发的降本增效,为未解决的临床需求带来新的希望。美谷分子最新推出的 ImageXpress HCS.ai 智能高内涵成像分析系统通过集成自动化微孔板处理和其他灵活配置,推动高通量成像的发展。
如您对自动化整合的智能高内涵成像分析系统感兴趣,欢迎扫描下方二维码,一键下载产品指南!



参考文献
[1] Saffari, A., Brechmann, B., Böger, C. et al. High-content screening identifies a small molecule that restores AP-4-dependent protein trafficking in neuronal models of AP-4-associated hereditary spastic paraplegia. Nat Commun 15, 584 (2024). https://doi.org/10.1038/s41467-023-44264-1
[2] Herpers, B., Eppink, B., James, M.I. et al. Functional patient-derived organoid screenings identify MCLA-158 as a therapeutic EGFR × LGR5 bispecific antibody with efficacy in epithelial tumors. Nat Cancer 3, 418–436 (2022). https://doi.org/10.1038/s43018-022-00359-0
