
抗体在细胞和基因治疗中具有重要作用,主要体现在以下几个方面:
1
靶向递送:抗体可以作为载体将治疗性基因或细胞特异性地递送到目标组织或细胞。通过将抗体与基因载体(如病毒载体、脂质体等)或细胞表面进行连接,利用抗体对靶细胞表面特定抗原的识别和结合能力,实现治疗物质的精准投递,提高治疗的特异性和效率,减少对非靶组织的副作用。
2
免疫调节:在细胞治疗中,抗体可以调节免疫细胞的功能。例如,免疫检查点抑制剂抗体(如抗 PD -1、抗 PD -L1、抗 CTLA - 4 等)可以解除肿瘤细胞对免疫细胞的抑制,增强免疫细胞对肿瘤细胞的杀伤作用,提高细胞治疗(如 CAR - T 细胞治疗、TCR - T 细胞治疗等)的疗效。
细胞标记和分选:在细胞治疗的制备过程中,抗体可用于对特定细胞类型进行标记和分选。例如,利用针对特定细胞表面标志物的抗体,可以从复杂的细胞混合物中分离出所需的细胞类型(如干细胞、免疫细胞等),用于后续的基因修饰和细胞治疗。
治疗效果监测:抗体可以用于检测细胞和基因治疗后的生物标志物,以监测治疗效果和疾病进展。例如,通过检测血液或组织中特定蛋白、细胞因子、肿瘤标志物等水平的变化,评估治疗后细胞或基因产物的功能和疗效。
清除不良反应细胞:在细胞治疗过程中,如果出现异常或不良反应的细胞(如脱靶的 CAR - T 细胞、过度增殖的免疫细胞等),可以利用特异性抗体结合这些细胞,通过抗体依赖的细胞毒性作用(ADCC)、补体依赖的细胞毒性作用(CDC)或其他免疫机制将其清除,控制治疗的不良反应。疫苗开发工作流程因所选平台(如灭活病毒与 DNA 疫苗)而不同,但每种平台都有其自己的优势。流行病防范创新联盟 (CEPI) 和许多其他组织在大流行病期间都会推广各种各样的方法,以增加成功抵御感染原的可能性。
从抗原/免疫原和抗体开发到稳定的细胞系开发,已创建了各种不同的病毒相关工作流程。以重组蛋白作为免疫原进行疫苗开发的一种通用工作流程为例。噬菌体展示技术在发病机制研究、疫苗、抗体药物及其他治疗方法开发中发挥关键作用。为了从噬菌体库 (107-1012 )中选择高亲和力结合体或配体,需要洗去非结合噬菌体,并且通过 3-5 轮的淘洗来收获与靶标分子特异性结合的噬菌体。为加快筛选速度,科学家们正在将 QPix 克隆筛选系统等新技术整合到工作流程中,以加快其噬菌体展示筛选速度。
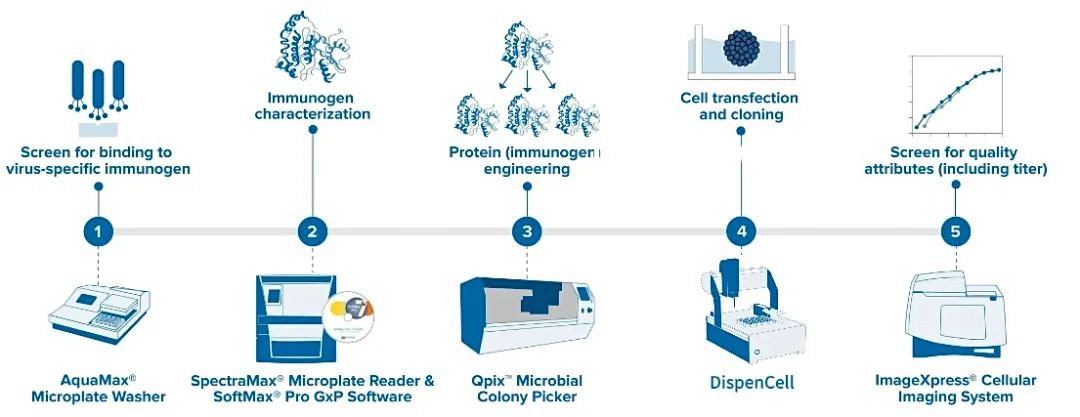
MD 设备与抗体开发 Workflow。
实验流程:
筛选与病毒特异性免疫原的结合 – 利用噬菌体展示技术通过结合情况来筛选病毒特异性免疫原(洗板机)
免疫原特性 – 描述主要候选免疫原的特性(酶标仪)
蛋白(免疫原)工程 – 优化主要免疫原的序列和结构,以增强抗病毒作用(克隆筛选 QPix)
细胞转染与克隆 – 将主要免疫原序列引入细胞中以进行蛋白表达
筛选滴度等质量属性 – 筛选转染细胞以确定具有高蛋白产量及所需质量属性的克隆(高内涵成像系统)
01
病毒抗体检测实例
具体实验举例:
❖
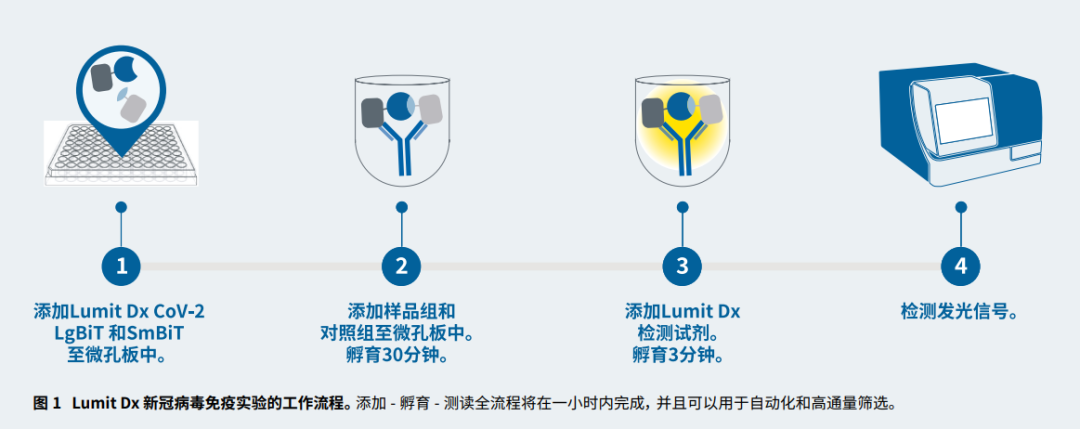
在血清样品中利用化学发光免疫实验检测新冠 lgG 抗体
在人体血清中,通过免疫实验检测病毒抗体,Promega Lumit Dx SARS-Cov-2 免疫实验使用带有 SmBiT 和 LgBiT 标记新冠病毒刺突蛋白受体结合区域的片段,当标记的病毒蛋白片段与新冠病毒抗体样品一起孵育,他们将与抗体结合,将 SmBiT 和 LgBiT 两个亚基结合在一起,产生功能性荧光素酶,添加 Lumit 检测试剂,在酶标仪上可测量产生荧光信号。(酶标仪 SpectraMax i3x,SpectraMax M5, SpectraMax L 可以测度)。
❖
定量检测血清样品中 SARS-CoV-2 spike 刺突蛋白和 Nucleocapsid 核衣壳蛋白的 lgG 抗体
Enzo 开发基于酶联免疫吸附实验 ELISA 方法,针对优化了检测人血清和血浆样品中抗 SARS-CoV-2 核衣壳蛋白 lgG 抗体和 SARS-CoV-2 刺突蛋白,是研究 COVID-19 感染抗体应答和免疫以及疫苗研究的关键工具。这两种 ELISA 试剂盒能扩展检测范围,提高灵敏度,特异性达到 95%,针对其目标分析物,核衣壳蛋白 lgG 抗体和刺突蛋白 lgG 抗体,分别在 30 分钟或 2 小时可以测定 86 个样品。这两个试剂盒在 SpectraMax ABS Plus 上可以方便运行,使用 SoftMax Pro 软件可以利用四参数拟合曲线,对样品进行半定量计算,并直接显示组内阳性和阴性结果。
❖
病毒中和抗体检测方法
疫苗诱导免疫应答的能力对于疫苗的开发至关重要,并且对于确定临床疗效也非常重要。血清抗体应答的测量是评估免疫原性的首选方法。功能性中和抗体检测通常用于检测能够有效中和病毒、防止离体感染的抗体量。
GeneScript cPass 新冠病毒中和抗体检测试剂盒采用免病毒中和检测法 sVNT 克服传统的病毒中和实验确定,采用酶联免疫吸附实验 ELISA 模式,刺突蛋白受体结合区域 HRP 偶联片段与含有中和性抗体的患者血清样品相结合。次混合物加入到已被 ACE2 受体包被 ELISA 孔板中,样品中抗体有中和抗体活性, HEP-RBD 同 ACE2 结合将被打破,随后清洗,移除 HRP-RBD,使用光吸收微孔板测定产生信号,在中和抗体存在情况下,信号会更低,将此信号与实验对照组相比,可评估待测样品中和抗体活性。SpectraMax 酶标仪和 SoftMax Pro 软件产生的数据能运用实验特异的方案进行分析,设置公式可以应用于所需的计算和自动结果输出,搭配 MultiWash+ 洗板机可以节约时间。
利用成像方式,可以对病毒减少中和试验(VRNT)进行成像验证。VRNT 对单个感染细胞进行计数,而非对大面积重叠的聚焦,与依赖整个孔的强度或报告病毒的传统微中和测定不同,VRNT 是快速的,其在未经改变的野生型病毒在感染后的第一天计数病毒感染的细胞,即能够在 1 天内计数一个感染细胞,而无需等待重叠的聚焦形成,从而确保准确性,有助于增加 VRNT 的精度和灵敏度。使用 SpectraMax i3X MiniMax 300 成像细胞计数仪和相应的 SoftMax Pro(Molecular Devices)软件,采集设置波长为 541 nm,焦距为 0 μm,曝光时间为 45 毫秒。MiniMax 能够在每个孔中采集 12 个区域(一个 3×4 的网格),包括整个孔以及孔外的区域。每个孔中可能的 12 个区域中的 4 个(大约 80% 的面积)被采集,以减少每个板的读取时间,并消除从孔边缘自发荧光中看到的假阳性计数。
❖
病毒滴定
病毒感染细胞的目的是为了进行复制,这是一项他们单凭自身无法完成的任务。测定无细胞样品中的病毒量无法提供有关其传染性的信息,因而限制了其有用性。相反,细胞成像可用于检测某种指定病毒感染培养基中细胞的能力。根据感染细胞分数来确定病毒浓度。噬斑检测是病毒学中早期开发的定量检测方法之一。它最初由 Renato Dulbecco 开发,用于测定感染因子跨细胞单层的增殖。高内涵成像来增强传统噬斑检测,这使他们能够以自动化和筛选兼容的方式成像并快速定量病毒斑块形成,以及许多其他选择标记物。通过使用 ImageXpress 共聚焦和宽场系统来分析病毒诱导的细胞事件,可研究感染期间发生的表型变化。多参数测定包括单个斑块水平或群体水平的感染密度、强度、面积、形状或位置信息。该团队采用了细胞和病毒的活细胞和终点成像,并将其与生化分析和数值模型相结合。这将对细胞功能和感染过程的潜在分子机制提供新的见解,并为临床研究和生物技术中的病毒应用奠定基础。这也许能实现新型抗病毒制剂的设计。
02
噬菌体展示技术
噬菌体展示技术在发病机制研究、疫苗、抗体药物及其他治疗方法开发中发挥关键作用。为了从噬菌体库 (107-1012 )中选择高亲和力结合体或配体,需要洗去非结合噬菌体,并且通过 3-5 轮的淘洗来收获与靶标分子特异性结合的噬菌体。为加快筛选速度,科学家们正在将 QPix 克隆筛选系统等新技术整合到工作流程中,以加快其噬菌体展示筛选速度。
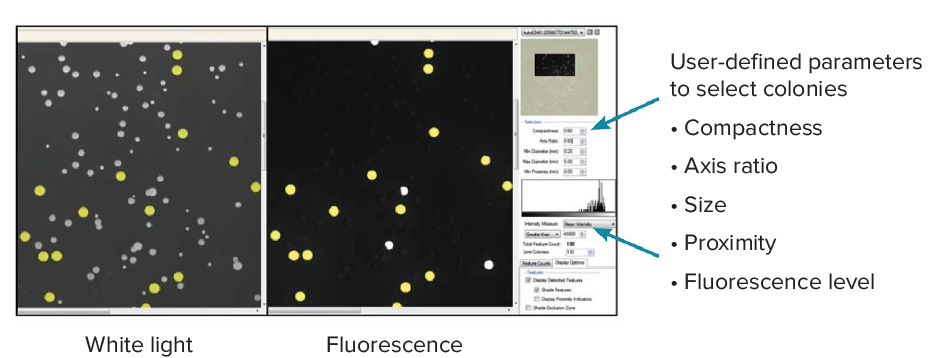
QPix 白光和荧光成像,可自定义圆度、轴比、直径、荧光强度等参数。
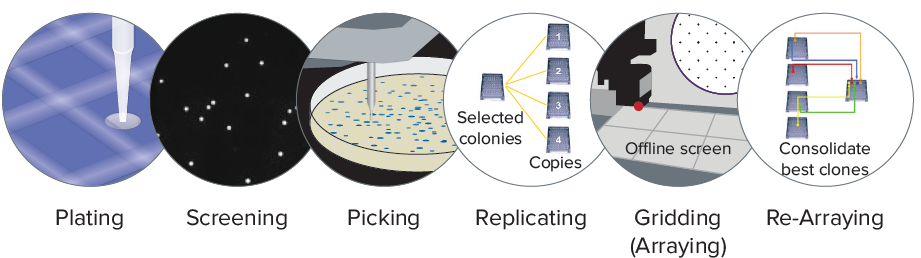
QPix 的多功能模块,如:涂板,删选、挑取、复制重排等。
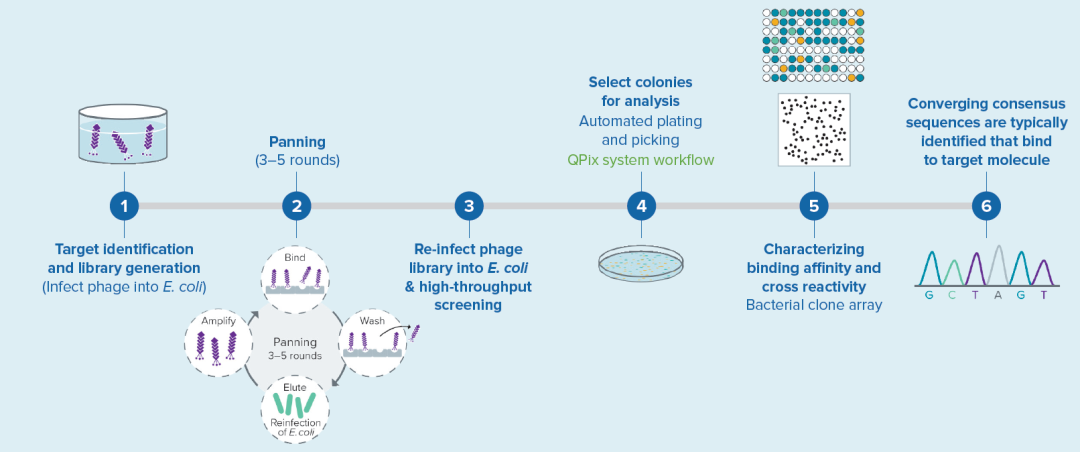
典型的噬菌体展示流程。
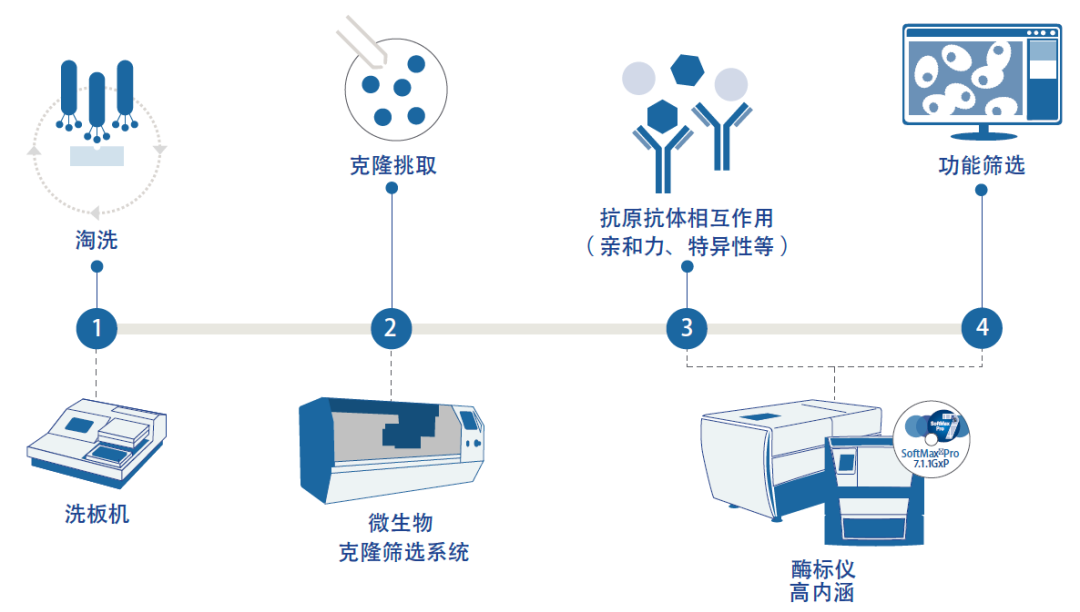
淘洗筛选 Workflow。
03
杂交瘤技术
传统的杂交瘤细胞筛选方法通常为有限稀释,效率比较低,通常需要额外的几次亚克隆用于提高单克隆的概率。半固体培养基的方法能够固定单个杂交瘤细胞的位置,支持细胞生长形成单个独立的克隆,通过荧光标记,可以实现原位筛选阳性克隆,一轮筛选即可获得高表达优质克隆。杂交瘤技术综合解决方案:
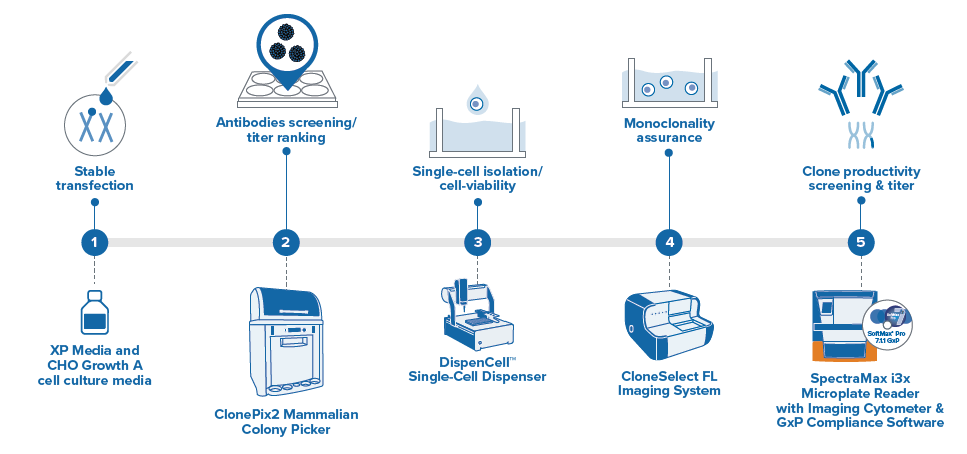
实验 Workflow。
具体实验结果:
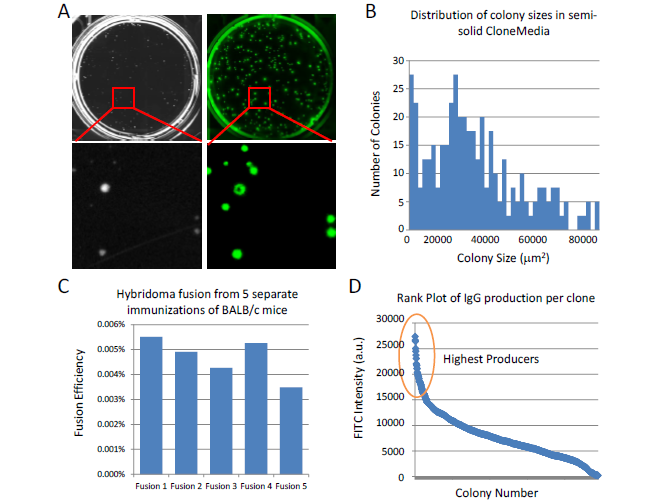
筛选特异性杂交瘤细胞克隆,融合后 7 天,用白光和 FITC 荧光通道成像,根据荧光强度进行排序。

Clonepix2 自动挑取。
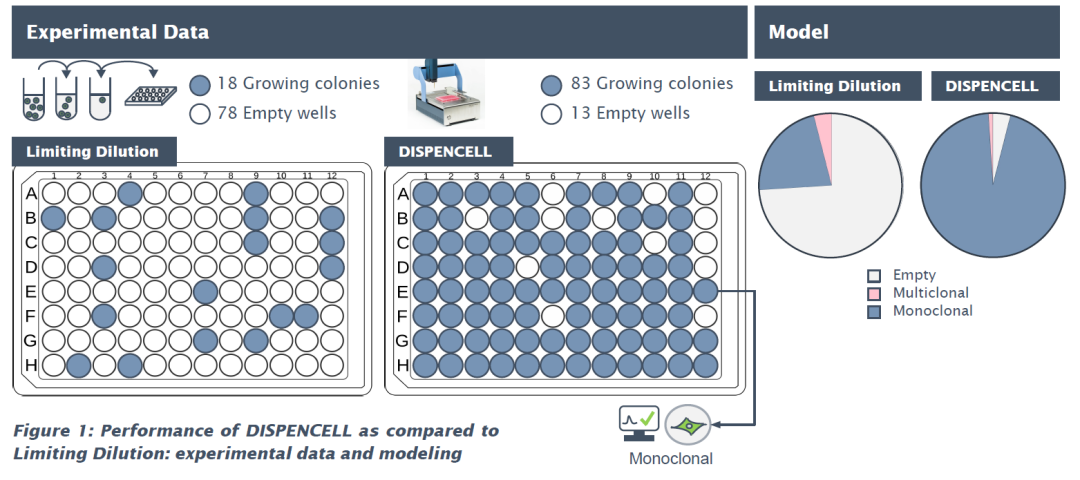
DispenCell 和有限稀释分离单细胞结果数据。
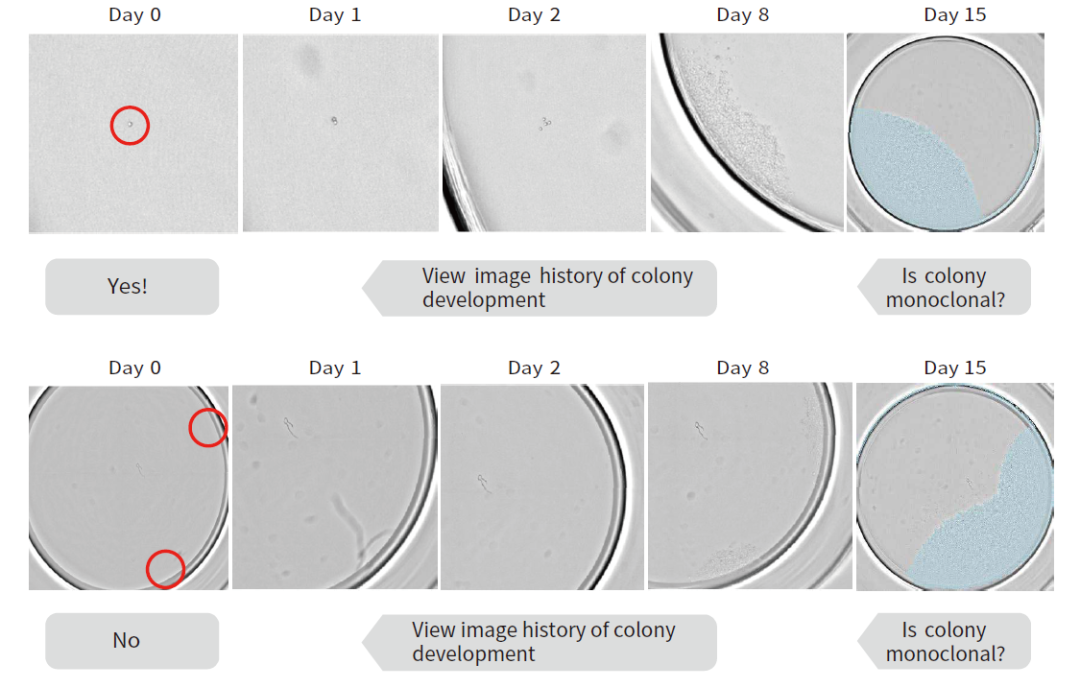
多天连续成像,追溯验证单克隆。
结 语
